日前,四川匯宇制藥以仿制藥4類申報上市的多西他賽注射液獲批生產,視同通過一致性評價。據米內網統計,截至1月27日,通過或視同通過一致性評價的注射劑有13個受理號(涉及9個品種),其中有3個品種已入選首批“4+7”帶量采購,5個品種有望入選第二批帶量采購。從目前進展看,注射劑一致性評價總體競爭格局良好,從申報一致性評價及按新注冊分類申請上市企業數看,12個品種申報企業數超5家,競爭較為激烈。
9個注射劑已有企業通過或視同通過一致性評價
2017年12月22日,CDE發布《已上市化學仿制藥(注射劑)一致性評價技術要求(征求意見稿)》,雖然只是“技術要求”文件,未明確具體執行時間及節點,但還是引起了業界的轟動。口服制劑一致性評價的陣痛還未結束,注射劑再評價也要來了!
相比于口服制劑,注射劑(不包括緩控釋制劑、混懸劑、油劑、脂質體等特殊制劑)在進行一致性評價時無需進行BE試驗,因此所花費的金錢較少,但在處方工藝、輔料、包裝、工藝控制等方面的要求較為嚴格,因此通過一致性評價的難度較大。
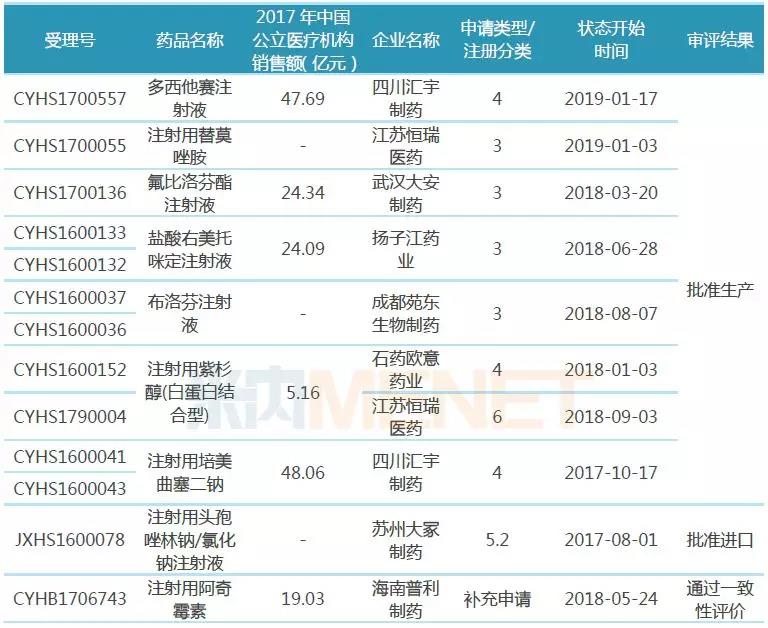
表1:通過或視同通過一致性評價的注射劑
據米內網統計,截至1月27日,CDE承辦的一致性評價補充申請受理號已有829個(涉及品種272個),其中屬于注射劑的受理號有178個(涉及品種71個);從通過情況看,通過或視同通過一致性評價的注射劑僅13個受理號,涉及品種數9個,涉及企業數8家。
海南普利制藥的注射用阿奇霉素是唯一按照一致性評價補充申請并通過的注射劑,其余12個受理號均按新注冊分類(仿制藥3類、仿制藥4類、進口5.2類)申請并獲批生產或進口,視同通過一致性評價。
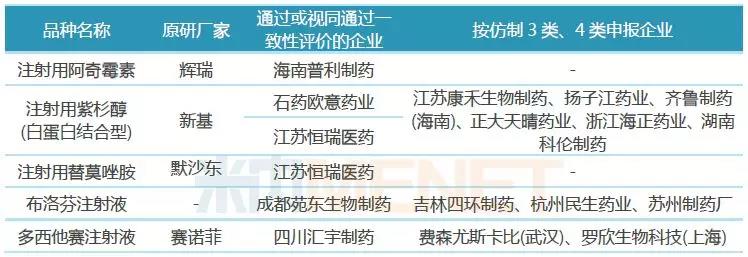
從各品種一致性評價通過情況看,除了注射用紫杉醇(白蛋白結合型)有石藥集團歐意藥業、江蘇恒瑞醫藥兩家企業通過外,其他品種均為獨家通過,競爭格局良好;從各品種在2017年中國公立醫療機構終端的銷售額看,5個品種為超10億大品種,替莫唑胺、布洛芬在2017年中國公立醫療機構終端的銷售額分別為18.55億元、10.19億元,在江蘇恒瑞醫藥、成都苑東生物制藥的產品獲批生產之前,還未有注射劑在國內上市銷售,這2家企業的產品因為按照新注冊分類提交上市申請并獲批生產,視同通過一致性評價,市場增長潛力大。
3個注射劑入選“4+7”帶量采購
表2:“4+7”帶量采購中選的注射劑
(來源:上海陽光醫藥采購網)
2018年12月17日,上海陽光醫藥采購網發布《關于公布4+7城市藥品集中采購中選結果的通知》,25個品種(涉及15家企業)中選,其中有3個品種屬于注射劑。
隨著一致性評價不斷推進,在第二批“4+7”帶量采購中,這3個注射劑或將面臨更激烈的競爭。目前注射用培美曲塞二鈉已有豪森藥業、齊魯制藥、揚子江藥業提交一致性評價申請,上海創諾制藥、費森尤斯卡比(武漢)醫藥、齊魯制藥(海南)等企業按仿制藥4類申報上市;氟比洛芬酯注射液暫未有企業提交一致性評價申請,但重慶藥友制藥、常州四藥制藥、山西普德藥業、廣東嘉博制藥等企業已按仿制藥3類申報上市;鹽酸右美托咪定注射液已有江蘇恒瑞醫藥、江蘇恩華藥業提交一致性評價申請,此外還有國藥集團、石藥銀湖制藥、四川美大康華康藥業等企業按仿制藥3類申報上市。
表3:有可能納入第二批帶量采購的注射劑
(來源:米內網MED中國藥品審評數據庫2.0)
2018年9月,“4+7”帶量采購網傳版流出,共涉及33個通用名藥品,注射用紫杉醇(白蛋白結合型)赫然在列,在正式集采文件中,該產品未被納入。注射用紫杉醇(白蛋白結合型)目前已有2家企業視同通過一致性評價,雖然還沒有企業申報一致性評價補充申請,但已有揚子江、齊魯、正大天晴等6家企業按仿制3類、4類申報上市,競爭非常激烈。
海南普利制藥的注射用阿奇霉素在首批帶量采購進入到預中標階段,在最終談判環節落標,目前該產品沒有企業進行一致性評價補充申請,也沒有企業按仿制3類、4類申報上市,競爭格局良好。
恒瑞醫藥的注射用替莫唑胺、成都苑東生物制藥的布洛芬注射液均按仿制藥3類申報并獲批生產,視同通過一致性評價,目前均沒有企業提交一致性評價補充申請;近50億大品種多西他賽注射液目前有江蘇恒瑞醫藥、正大天晴藥業提交一致性評價補充申請,費森尤斯卡比(武漢)、羅欣生物科技(上海)等按仿制藥4類提交上市申請。
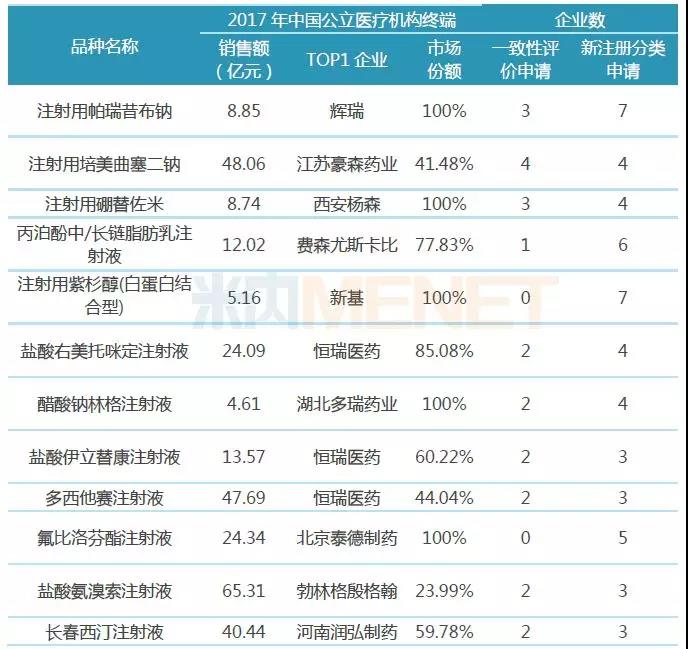
12個注射劑申報企業數超5家
表3:12個注射劑按一致性評價補充申請及新注冊分類申報上市企業數超5家
(來源:米內網數據庫)
從申報企業數看,有12個注射劑按一致性評價補充申請及仿制3類、4類申報上市的合計企業數超過5家(企業數按集團計),競爭較為激烈,有可能在2019年會有企業通過或視同通過一致性評價,入選第二批“4+7”帶量采購。
注射用帕瑞昔布鈉以10個企業申請成為最大競爭熱點,目前國內市場僅原研廠家輝瑞的產品有上市銷售;注射用培美曲塞二鈉以8個申請企業緊接其后,該品種已有四川匯宇制藥視同通過一致性評價,正在申報一致性評價的齊魯制藥的產品以“同一生產線生產,已于2017年在美國上市”為由納入優先審評,有望快速通過一致性評價。
“出口轉報國內”已經成為國內企業布局一致性評價必選途徑,如恒瑞醫藥,正在申請一致性評價的鹽酸伊立替康注射液、多西他賽注射液、鹽酸右美托咪定注射液等均已在美國獲得ANDA批文,碘克沙醇注射液也于日前在德國獲批上市。據米內網數據,2017年中國公立醫療機構終端,這4大品種銷售額均超過10億元,恒瑞醫藥均占據主要市場份額。
注射用紫杉醇(白蛋白結合型)、氟比洛芬酯注射液這2個品種雖然未有企業處于一致性評價申請階段,但均有5家及5家以上企業按新注冊分類申請上市,從目前注射劑一致性評價通過情況看,絕大多數注射劑是按新注冊分類申報上市,獲批生產后視同通過一致性評價,這不失為一條搶跑注射劑一致性評價的“捷徑”。